横浜国立大学 大学院工学府 機能発現工学専攻 先端物質化学コース
理工学部 化学・生命系学科 化学教育プログラム
川村研究室
研究概要
- 本研究室では生体分子が機能する上で重要な構造や運動性などの性質を明らかにし、生体分子の働きを分子レベルで理解することを目指しています。
生体分子の中でも細胞膜上の膜タンパク質は信号伝達、イオン透過、物質輸送などを制御して生命活動に重要な役割を果たしています。 また、細胞膜は抗菌活性ペプチドの反応場やアミロイド線維との相互作用などにおいてもその分子機構は注目を集めています。 このような細胞膜に結合した状態の分子構造情報を得ることは難しい課題でありますが、本研究室では、内藤研究室の伝統を引き継ぎながら、固体高分解能NMRの手法をはじめとした物理化学計測を駆使して、細胞膜結合分子との構造と機能の相関を分子論的に明らかにする研究を展開しています。以下に我々の研究内容を紹介いたします。
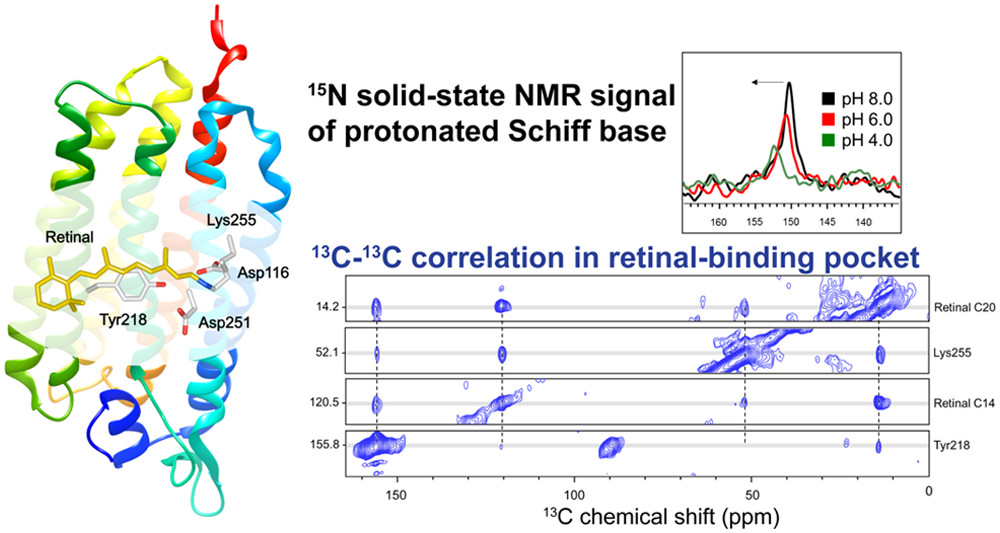
- 相関NMRによる発色団-周辺アミノ酸残基の間の相互作用の解析
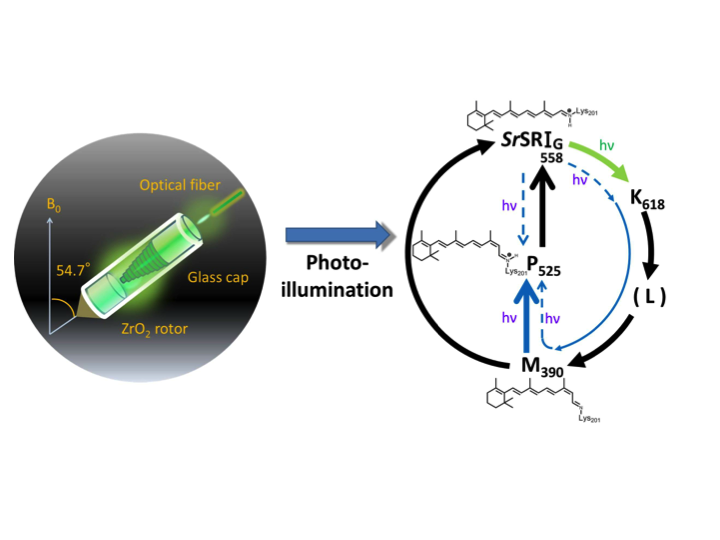
- In-situ光照射固体NMR法による微生物型ロドプシンの光中間体の観測
高分解能固体NMRの標準的なテクニックであるマジック角回転(MAS)条件の下、測定試料に対して光照射することによって、光反応によるNMRスペクトルの変化について観測ができる手法を開発しました[2,3,4]。この手法を用いて、フォトサイクル反応をもつ微生物型ロドプシンのレチナール異性化反応に基づく光中間体を観測することに成功しています[4,5,6]。
[2] I. Kawamura, N. Kihara, M. Ohmine, K. Nishimura, S. Tuzi, H. Saito, A. Naito*. (2007) J. Am. Chem. Soc. 129 1016-1017.
[3] I. Kawamura, Y. Degawa, S. Yamaguchi, K. Nishimura, S. Tuzi, H. Saito, A. Naito*. (2007) Photochem. Photobiol. 83 346-350.
[4] Y. Tomonaga, T. Hidaka, I. Kawamura, T. Nishio, K. Osawa, T. Okitsu, A. Wada, Y. Sudo, N. Kamo, A. Ramamoorthy, A. Naito*. (2011) Biophys. J. 101 L50-L52.
[5] H. Yomoda, Y. Makino, Y. Tomonaga, T. Hidaka, I. Kawamura*, T. Okitsu, A. Wada, Y. Sudo*, A. Naito*. (2014) Angew. Chem. Int. Ed. 53 6960-6964.
[6] K. Oshima, A. Shigeta, Y. Makino, I. Kawamura*, T. Okitsu, A. Wada, S. Tuzi, T. Iwasa, A. Naito*. (2015) Photochem. Photobiol. Sci.14 1696-1704.
In-situ光照射-固体NMR法によるセンサリーロドプシンIの光中間体の観測 [5]
世界の分光学情報を紹介するspectroscopyNOW.comにJournal highlightとして紹介されました。 - 抗菌ペプチドの構造-機能相関の研究
両生類由来の抗菌ペプチドの一部は細菌の膜に欠損を与え、抗菌性を発現するとされています。その中でもDアミノ酸を有する抗菌ペプチドはしばしば活性が増加することがある。我々はD体のアロイソロイシンを残基としてもつボンビニンH4の細胞膜の相互作用について調べ、その相互作用にこの残基を含むN端のコンフォメーションが重要であることを見出しました。
[7] Batsaikhan Mijiddorj, Shiho Kaneda, Hisako Sato, Yuki Kitahashi, Namsrai Javkhlantugs, Akira Naito, Kazuyoshi Ueda*, Izuru Kawamura* (2018) BBA -Proteins and Proteomics- in press
[8] Hisako Sato, Izuru Kawamura, Akihiko Yamagishi, Fumi Sato. (2017) Chem. Lett. 46 (4), 449 - 452.
[9] Kazushi Norisada, Namsrai Javkhlantugs, Daisuke Mishima, Izuru Kawamura, Hazime Saito, Kazuyoshi Ueda*, and Akira Naito*. (2017) J. Phys. Chem. B 121(8),1802-1811. - アミロイド線維形成タンパク質の線維形成メカニズムに関する研究
- 新規固体NMR測定法の開発
[1] A. Shigeta, S. Ito, K. Inoue, T. Okitsu, A. Wada, H. Kandori, I. Kawamura*. (2017) Biochemistry 56, 543-550.