
横浜国立大学 大学院理工学府化学・生命系理工学専攻
理工学部 化学・生命系学科 化学教育プログラム川村研究室

研究紹介

川村研究室では生体分子が機能する上で必要な構造や運動性などを明らかにし、生体分子の働きを分子レベルで理解することを目指しています。また、生体分子の分子設計・構造情報を元に新しい機能性材料の開発を目指します。 我々の研究対象は膜タンパク質(Membrane proteins)、抗菌性ペプチド(Antimicrobial peptides)、ペプチドの自己組織化 (Self-assembly of peptide)、セルロースナノファイバー (cellulose nanofiber)などです。生体分子の中でも細胞膜上の膜タンパク質は信号伝達、イオン透過、物質輸送などを制御して生命活動に重要な役割を果たしています。 また、細胞膜は抗菌活性ペプチドの反応場やアミロイド線維との相互作用などにおいてもその分子機構は注目を集めています。 このような細胞膜に結合した状態の分子構造情報を得ることは難しい課題でありますが、本研究室では、内藤研究室の伝統を引き継ぎながら、固体高分解能NMRの手法をはじめとした物理化学計測を駆使して、細胞膜結合分子との構造と機能の相関を分子論的に明らかにする研究を展開しています。さらに、自己組織化するペプチドの分子設計・構造解析やコーヒー粕由来のセルロースナノファイバーの構造解析によって新たな材料の可能性を追求しています。
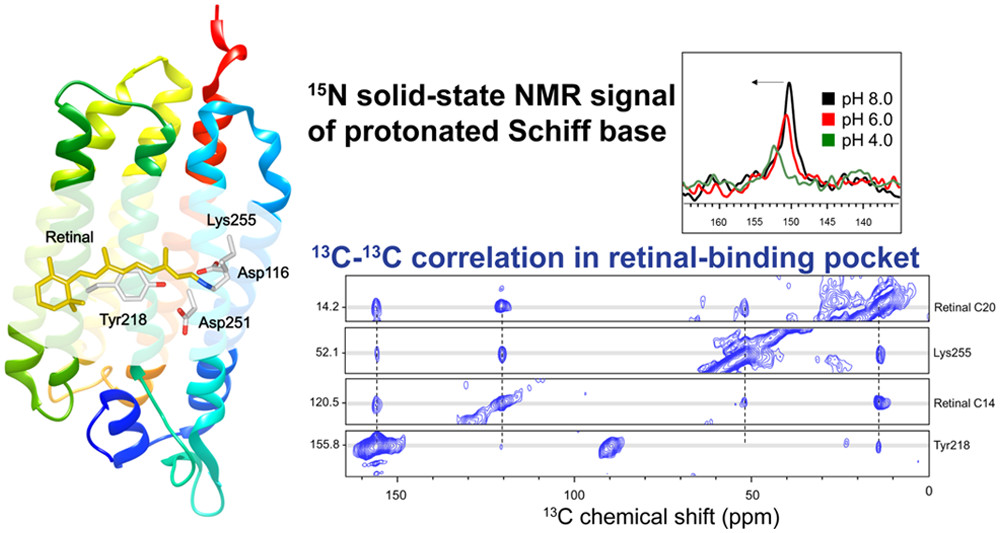
相関NMRによる発色団-周辺アミノ酸残基の間の相互作用の解析
ロドプシンタンパク質の反応中心であるレチナール結合部位はその周辺アミノ酸残基との相互作用により、機能と色を制御していると考えられる。我々はレチナールとともに微生物型ロドプシンの間で高く保存されているTyrに注目し、固体NMRの相関実験などを用いてレチナール結合部位の構造解析を行っています。[1]
- [1] A. Shigeta, S. Ito, K. Inoue, T. Okitsu, A. Wada, H. Kandori, I. Kawamura*. (2017) Biochemistry 56, 543-550.
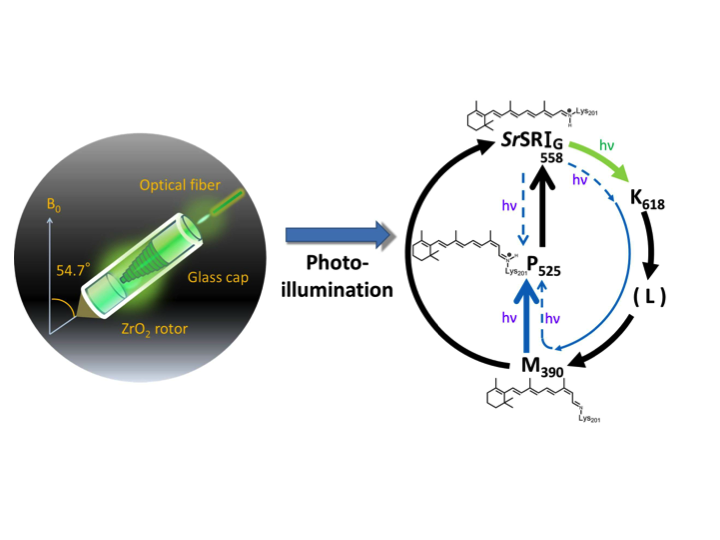
In-situ光照射固体NMR法による微生物型ロドプシンの光中間体の観測
高分解能固体NMRの標準的なテクニックであるマジック角回転(MAS)条件の下、測定試料に対して光照射することによって、光反応によるNMRスペクトルの変化について観測ができる手法を開発しました[2,3,4]。この手法を用いて、フォトサイクル反応をもつ微生物型ロドプシンのレチナール異性化反応に基づく光中間体を観測することに成功しています[4,5,6]。
- [2] I. Kawamura, N. Kihara, M. Ohmine, K. Nishimura, S. Tuzi, H. Saito, A. Naito*. (2007) J. Am. Chem. Soc. 129 1016-1017.
- [3] I. Kawamura, Y. Degawa, S. Yamaguchi, K. Nishimura, S. Tuzi, H. Saito, A. Naito*. (2007) Photochem. Photobiol. 83 346-350.
- [4] Y. Tomonaga, T. Hidaka, I. Kawamura, T. Nishio, K. Osawa, T. Okitsu, A. Wada, Y. Sudo, N. Kamo, A. Ramamoorthy, A. Naito*. (2011) Biophys. J. 101 L50-L52.
- [5] H. Yomoda, Y. Makino, Y. Tomonaga, T. Hidaka, I. Kawamura*, T. Okitsu, A. Wada, Y. Sudo*, A. Naito*. (2014) Angew. Chem. Int. Ed. 53 6960-6964.
- [6] K. Oshima, A. Shigeta, Y. Makino, I. Kawamura*, T. Okitsu, A. Wada, S. Tuzi, T. Iwasa, A. Naito*. (2015) Photochem. Photobiol. Sci.14 1696-1704.
世界の分光学情報を紹介するspectroscopyNOW.comにJournal highlightとして紹介されました。
抗菌ペプチドの構造-機能相関の研究
両生類由来の抗菌ペプチドの一部は細菌の膜に欠損を与え、抗菌性を発現するとされています。その中でもDアミノ酸を有する抗菌ペプチドはしばしば活性が増加することがある。我々はD体のアロイソロイシンを残基としてもつボンビニンH4の細胞膜の相互作用について調べ、その相互作用にこの残基を含むN端のコンフォメーションが重要であることを見出しました。
- [7] Batsaikhan Mijiddorj, Shiho Kaneda, Hisako Sato, Yuki Kitahashi, Namsrai Javkhlantugs, Akira Naito, Kazuyoshi Ueda*, Izuru Kawamura* (2018) BBA -Proteins and Proteomics- in press
- [8] Hisako Sato, Izuru Kawamura, Akihiko Yamagishi, Fumi Sato. (2017) Chem. Lett. 46 (4), 449 - 452.
- [9] Kazushi Norisada, Namsrai Javkhlantugs, Daisuke Mishima, Izuru Kawamura, Hazime Saito, Kazuyoshi Ueda*, and Akira Naito*. (2017) J. Phys. Chem. B 121(8),1802-1811.

